به گزارش ایراسین، در سال ۲۰۲۰، تولید سرباره فولاد در چین به ۱۶۰ میلیون تن رسید. میزان استفاده جامع از سرباره فولاد در ایالاتمتحده، اروپا، ژاپن و سایر کشورهای صنعتی ۸۵ تا ۹۸ درصد است، درحالیکه این میزان در چین تقریباً ۲۹.۵ درصد است.
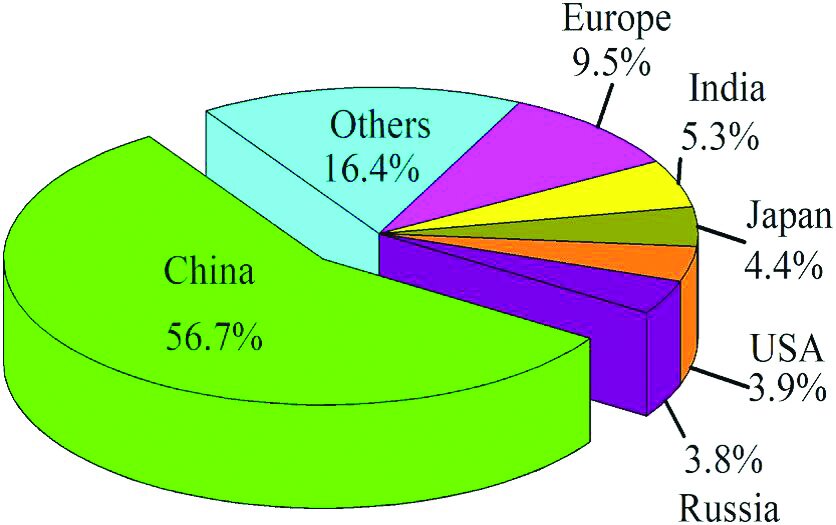
شکل (۱): تولید فولاد در مناطق مختلف جهان در سال ۲۰۲۰
مقدار زیادی از سرباره فولاد هنوز در هوای آزاد انباشته میشود که نهتنها مقدار زیادی از منابع زمینی را اشغال میکند، بلکه پس از یک دوره فرسایش، منجر به مهاجرت برخی از مواد سمی و مضر از سرباره فولاد به خاک، آبهای زیرزمینی و هوا میشود که منجر به اشکال مختلف آلودگی و مشکلات زیستمحیطی میگردد.
سرباره فولاد یک ماده قلیایی است که عمدتاً از اکسیدهای مختلفی ازجمله CaO، SiO۲، Fe۲O۳، Al۲O۳، MgO، MnO و مواد قلیایی مختلف تشکیل شده است که میتواند توسط آب برای آزاد کردن یون OH- به کار رود. از نظر میکروسکوپی، سطح ذرات سرباره فولاد، چینهای کمی مقعر و محدب را نشان میدهد که با ساختارهای متخلخل با توزیع تصادفی منافذ و ریزترکها مشخص میشود و سطح ویژه بزرگی با ظرفیت جذب و رسوب بالا ارائه میکند.
گزارش شده است که سرباره فولاد بهعنوان جاذب برای حذف فسفات، آمونیاک، نیتروژن، سولفید، آلایندههای آلی و یونهای فلزات سنگین (مس، آرسنیک، سرب، منگنز، کروم، نیکل و روی)، با نتایج حذف کافی مورد استفاده قرار گرفته است.
حذف فسفات به روش ترسیب شیمیایی توسط سرباره فولاد
سرباره فولاد که حاوی مقدار زیادی Al۲O۳، MgO، CaO و سایر اکسیدهای فلزات قلیایی است، پس از اضافه شدن به محیط آبی بهدلیل هیدرولیز مخلوط اکسیدهای فلزی، مقدار زیادی OH آزاد میکند. آلایندههای موجود در محیط آبی میتوانند با OH ترکیب شوند و رسوبات شیمیایی ایجاد کنند که سبب حذف آلودگی میشود.
حذف یون فسفات از سرباره فولاد بر اساس مکانیسم زیر است: فسفات موجود در محیط آبی با جذب سطحی بر روی سطح سرباره فولاد جذب میشود و با یونهای فلزی مانند Ca۲+، Mg۲+ و Al۳+ آزادشده توسط یونیزاسیون هیدرولیکی سرباره فولاد در آب، واکنش شیمیایی میدهد؛ بنابراین، هنگامیکه pH بحرانی رسوب فسفات به دست میآید، رسوبات فسفات تشکیل میشود و در نتیجه فسفر از آب حذف میشود.
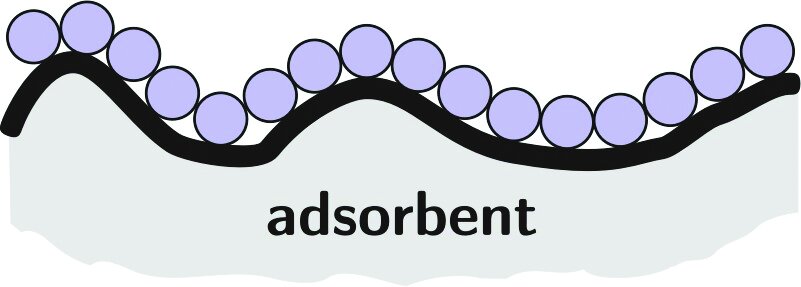
شکل ۲ فرایندهای واکنش اصلی برای حذف فسفات با جذب روی سرباره فولاد را نشان میدهد. در میان یونهای فلزی محلول در سرباره فولاد، غلظت یون Ca عامل کلیدی برای حذف فسفر توسط جذب سرباره است. مقدار زیادی یون Ca روی سطح سرباره فولاد حل میشود و با فسفات موجود در فاضلاب واکنش شیمیایی میدهد و رسوب هیدروکسی آپاتیت (HAP) (Ca۵(PO۴)۳(OH)) نسبتاً پایدار را تشکیل میدهد. مکانیسمهای اصلی حذف فسفات به شرح زیر است:
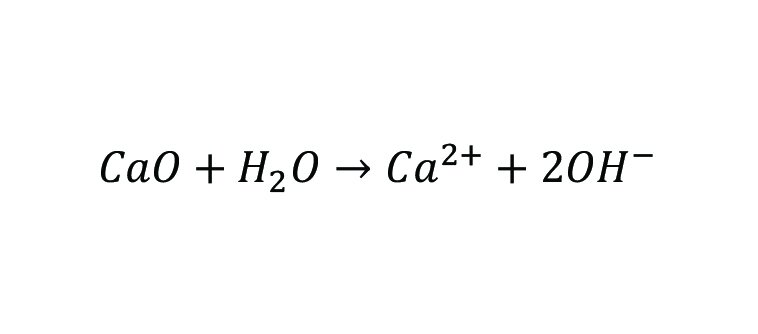
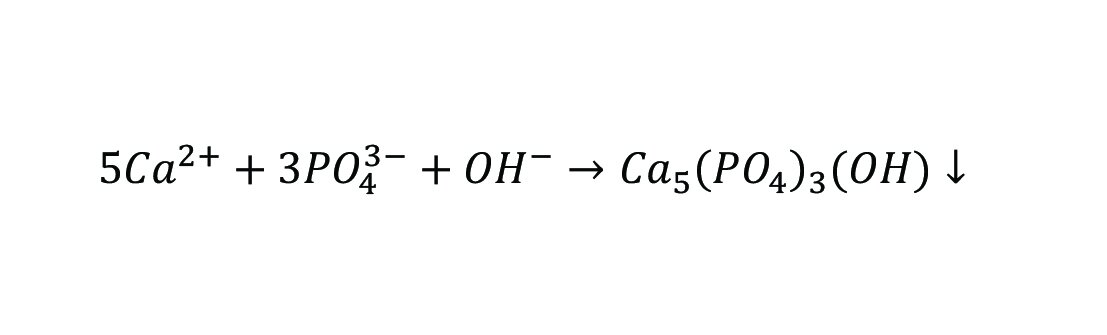
ازآنجاکه سرباره فولاد حاوی ترکیباتی مانند ۲CaO-SiO۲، CaCO۳ و Ca(OH)۲ است، این مواد نیز در محلول حل میشوند و یونهای Ca را تشکیل میدهند، که برای دستیابی به حذف فسفات به واکنشهای رسوبی تکیه میکنند.
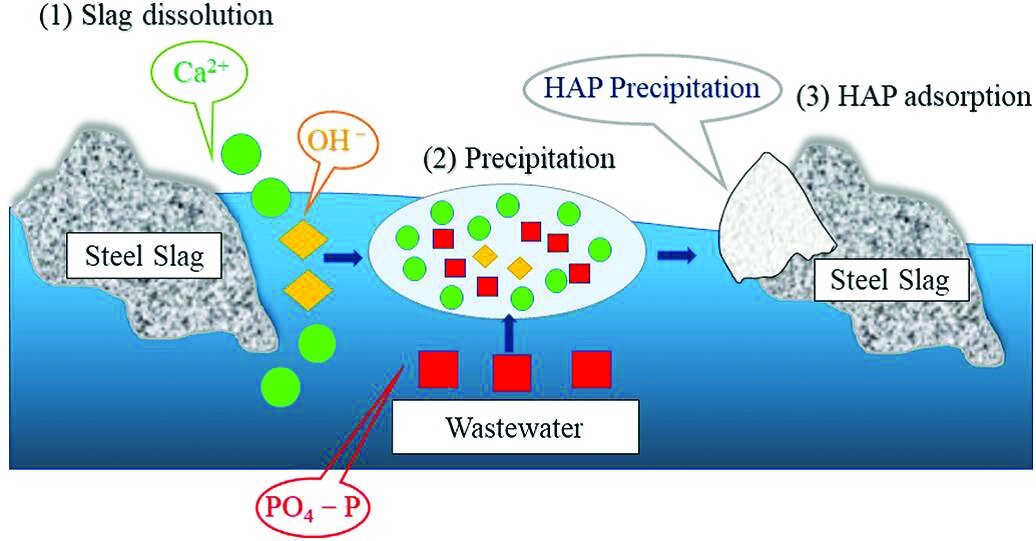
شکل (۲): فرایند واکنش حذف فسفات با جذب توسط سرباره فولاد
حذف هیدروژن سولفید بهوسیله سرباره فولاد
سولفید هیدروژن (H۲S) از احیای یونهای سولفات توسط باکتریهای احیاکننده سولفات در رسوبات غنی از مواد آلی در شرایط بدون اکسیژن تشکیل میشود. سولفید هیدروژن باعث تخریب اکولوژیکی، بوی بد و سایر مسائل زیستمحیطی میشود و برای موجودات زنده بسیار سمی است. بنابراین، کاهش غلظت سولفید هیدروژن در رسوبات برای بازسازی و حفظ اکوسیستمهای آبی سالم حیاتی است. نحوه عمل و تغییر ماده برای مهار تولید سولفید هیدروژن در شکل ۳ نشان داده شده که قبل از استفاده از سرباره فولادی، باکتریهای احیاکننده سولفات، یونهای سولفات را در آب دریا کاهش میدهند تا در رسوب پایینی غنیشده با مواد آلی، سولفید هیدروژن تشکیل دهند. ریختن سرباره فولادی بر روی رسوب از تولید سولفید هیدروژن با کاهش تماس بین یونهای سولفات و باکتریهای کاهنده سولفات در رسوب جلوگیری میکند.
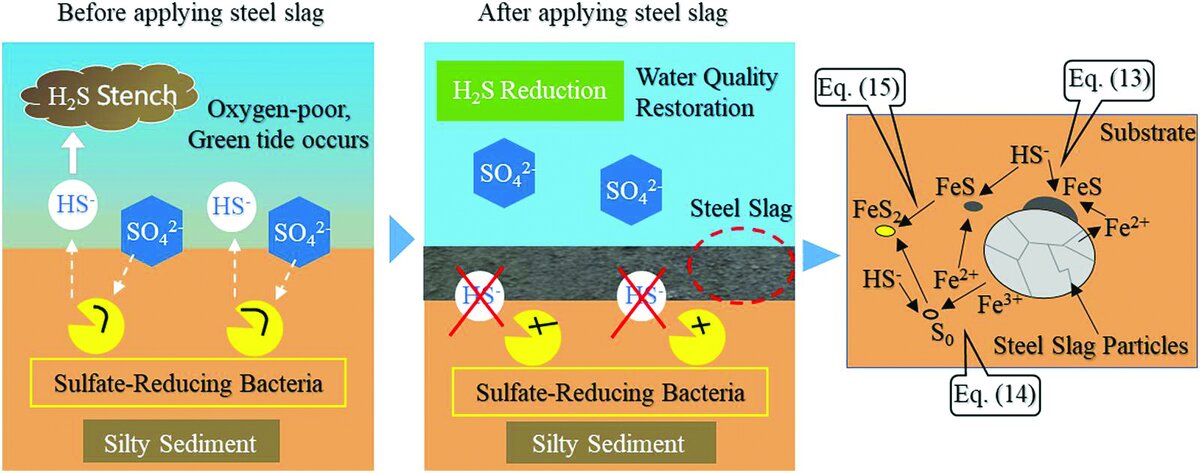
شکل (۳): سرباره فولاد تولید سولفید هیدروژن را مهار میکند


ارسال نظر